Como
hemos dicho, todos los átomos de un mismo elemento tiene el mismo
número de protones. Al número de protones se le denomina número
atómico (Z). Los elementos de la Tabla Periódica están ordenados
según su número atómico:
Hidrógeno (H), 1 protón
Helio (He), 2 protones
Litio (Li), 3 protones
Berilio (Be), 4 protones
Boro (B), 5 protones
.....
Al
tratarse de un átomo, debe ser neutro, luego PROTONES = ELECTRONES.
En
el caso de un ión, PROTONES + ELECTRONES = CARGA. Por ejemplo, el
ión
S2-.El
azufre tiene número atómico 16, tanto el átomo como sus iones.
Luego tiene 16 protones. No sabemos el número de electrones, le
llamaremos “x”. La carga es -2. Luego:
16
+ x = -2
x
= nº de electrones = -18
Como
hemos dicho, la masa del electrón es despreciable. Luego toda la
masa se encuentra en el núcleo, distribuida entre el protón y el
neutrón. La suma del número de protones y de neutrones se llama
número másico (A).
PROTONES
+ NEUTRONES = NÚMERO MÁSICO
Todos
los isótopos del azufre tienen 16 protones. El número de neutrones
varía según el isótopo. Luego cada isótopo tiene un número
másico distinto. El azufre tiene 4 isótopos:
32S
33S
34S
36S
El
número es el número másico. Como todos tienen 16 protones (mismo elemento, el azufre):
32
– 16 = 16 neutrones
33
– 16 = 17 neutrones
34
– 16 = 18 neutrones
36
– 16 = 20 neutrones
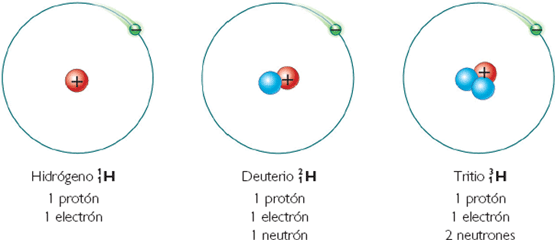
De especial interés son los isótopos de hidrógeno. El más abundante es el protio (A = 1, luego como el hidrógeno tiene 1 protón, tiene 0 neutrones). Le sigue el deuterio (A=2, 1 protón, 1 neutrón), y mucho menos abundante el tritio (A=3, 1 protón, 2 neutrones).
Cuando un átomo tiene mucho más neutrones que protones, suele hacerse inestable, o sea, radiactivo. Por ejemplo, el 3-hidrógeno o tritio es radiactivo.
ALGUNOS EJERCICIOS PARA PRACTICAR
ALGUNOS EJERCICIOS PARA PRACTICAR

No hay comentarios:
Publicar un comentario