Combinaciones del oxígeno con nitrógeno. La fórmula
de un óxido dijimos que era:
X2Ox,
siendo X, en este caso, el nitrógeno (N) y x la valencia con la que
actúe
El
nitrógeno tiene muchas valencias. No me quiero meter todavía en ese
tema, así que solo diremos que x puede ser 1, 2, 3, 4 y 5. Así que
los óxidos de nitrógeno son:
N2O1
→ N2O (monóxido de dinitrógeno)
N2O2
→ NO (monóxido de nitrógeno)
N2O3
(trióxido de dinitrógeno)
N2O4
→ NO2 (dióxido de nitrógeno)
N2O5
(pentaóxido de dinitrógeno)
Vamos
a hablar un poco de cada uno de ellos:
N2O
Es
un gas incoloro, el “gas de la risa” que usan los dentistas en
las películas.
NO
Es
un gas incoloro muy inestable, y no tarda en convertirse en NO2.
N2O3
Es
un líquido azul muy inestable a temperatura ambiente, y no tarda en
convertirse en NO y NO2.
NO2
Es
un gas de color pardo (ver imagen).
N2O5
Es
un sólido blanco inestable a bajas temperaturas.
La
actividad humana produce un aumento de la concentración de muchos
gases, como el CO2 (dióxido de carbono), el CO (monóxido de
carbono), el SO2 (dióxido de azufre), el CH4 (metano), el O3
(ozono), los CFC (clorofluorocarburos), el NO (monóxido de
nitrógeno) o el NO2 (dióxido de nitrógeno). Todos estos tienen un
efecto nocivo sobre el medio ambiente y la salud de las personas.
Vamos
a centrarnos en los dos óxidos de nitrógeno, el NO y el NO2. ¿Por
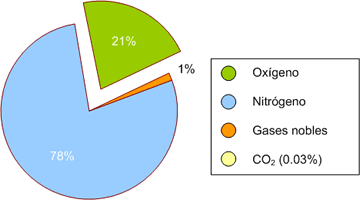
qué se producen? Veamos la composición de la atmósfera:
El 78 % del aire que respiramos es N2 y el 21 % es O2, así que las combinaciones, la formación de óxidos de nitrógeno, deberían ser frecuentes. ¿Lo son? La concentración de NO2 en una ciudad española no puede ser mayor a 40 mg / m3, o sea, 0'00004 g / L. Esto es muy poco.
¿Por qué el N2 no se combina con el O2 con más frecuencia? Porque estas reacciones:
N2 + O2 → 2NO
N2 + 2O2 → 2NO2
Precisan de elevadas temperaturas para darse. Esas temperaturas no se encuentran en el medio natural, exceptuando un volcán.
Pero en una ciudad, sí. ¿Dónde? Por ejemplo, los motores de los coches, que pueden alcanzar temperaturas de 600 ºC, más que suficientes como para que estas reacciones se den. El nitrógeno y el oxígeno del aire en contacto con el tubo de escape, muy caliente, se combinan dando NO y NO2. También ocurre esto en las chimeneas de las fábricas y en los motores de los aviones.
Veremos un ejercicio de aplicación de la prueba de Ciencias de la Tierra (CTM) de Selectividad relacionado con el tema. El ejercicio nos pide que interpretemos esta gráfica:
En esta gráfica se representa como varía las concentraciones de algunos productos contaminantes a lo largo de un día. Nos centraremos en los niveles de NO y NO2.
Vemos que el NO tiene su momento de mayor concentración entorno a las 7 de la mañana. El NO2 lo tiene una hora más tarde, a las 8. ¿Por qué a esa hora? ¿Por qué no coincide?
A esa hora porque es el momento de mayor tráfico (trabajo, colegios, institutos). Al haber más tráfico, hay más coches, al haber más coches, hay más tubos de escapes. Y al haber más tubos de escapes, más NO y NO2 se produce. También es el momento en el que las fábricas empiezan a funcionar.
Pero, aunque la concentración de NO2 aumenta, no alcanza su máximo hasta una hora más tarde. Esto es debido a que, como he dicho al principio, el NO es inestable, y no tarda es convertirse en NO2. Pero este proceso requiere un tiempo, por eso no coinciden.
En resumen, lo que ocurre es esto:
N2 + O2 → NO
N2 + O2 → NO2
2NO + O2 → 2NO2
Pero, ¿por qué es malo el NO y el NO2? Son gases que irritan el aparato respiratorio (peligroso para pacientes con asma) y los ojos. La exposición provoca tos, mareos y náuseas; y puede provocar daños a las células pulmonares y los alvéolos.
No solo produce efectos negativos sobre la salud humana, también sobre la capa de ozono. Cuando incide radiación ultravioleta (UV) sobre el NO2, se descompone en NO y un radical de oxígeno:
NO2 + UV→ NO + O·
El radical de oxígeno es muy inestable, y reacciona con el O2 del aire dando lugar a ozono:
O2 + O· → O3
Te preguntarás que, si el ozono es bueno, ¿entonces por qué es malo el NO2, si permite que se forme ozono? El ozono es bueno lejos de nosotros, en la estratosfera (ya que nos protege de la mayor parte de radiación UV que recibimos del Sol); pero cerca de nosotros, en la troposfera, es un gas irritante. O sea, el ozono es bueno a 30 kilómetros de altura y cuando está cerca del nivel del mar es un contaminante.
 Además, el ozono es un potente oxidante que permite que se de multitud de reacciones, que tienen como productos contaminantes como los aldehídos, las cetonas, el PAN ... La mezcla de todos esos gases forma el llamado smog fotoquímico, esa niebla típica de las grandes ciudades (ver imagen).
Además, el ozono es un potente oxidante que permite que se de multitud de reacciones, que tienen como productos contaminantes como los aldehídos, las cetonas, el PAN ... La mezcla de todos esos gases forma el llamado smog fotoquímico, esa niebla típica de las grandes ciudades (ver imagen). En definitiva:
NO2 → O3 → contaminantes que forman el smog fotoquímico
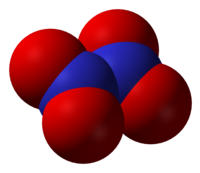
Muy gustaría ahora hablar de un óxido de nitrógeno que no hemos mencionado, el N2O4. ¿Por qué no se simplifica, quedándose en NO2? Porque no tenemos esto (azul es el nitrógeno, rojo es el oxígeno):
Como ocurre en el NO2. En el N2O4 tenemos esto:
O sea, 2 NO2 unidos (a esto se le llama anhídrido). Se trata de un gas utilizado como combustible de cohetes, ya que reacciona de manera muy energética con la hidrazina (N2H4):
N2O4 + 2N2H4 → 3N2 + 4 H2O