En el próximo curso, se tratará la nomenclatura de compuestos ternarios (3 elementos) y cuaternarios (4 elementos), además de la formulación y nomenclatura de los compuestos orgánicos (compuestos con carbono, excepto CO, CO2, H2CO3, CO₃²⁻ , HCO₃⁻ ).
CO: inorgánico binario (2 elementos, C, O)
H2CO3 : inorgánico ternario (3 elementoss, H, C, O)
NaHCO3: inorgánico cuaternario (4 elementos, Na, H, C, O)
CH3 - CH2 - OH: orgánico
La diferencia entre formulación y nomenclatura es:
FORMULACIÓN: nos dan el nombre y tenemos que dar la fórmula
Cloruro de sodio = NaCl
NOMENCLATURA: nos dan la fórmula y tenemos que dar el nombre
NaCl = Cloruro de sodio
Cada elementos tiene una valencias, que sin ánimo de meterme mucho en este asunto (más propio de Química Intermedia), tan solo he dedecir que si la valencia de un elemento es 2, un átomo de ese elemento se puede unir a otros dos átomos. La tabla con las valencias de los elementos más importantes es esta.
Por último, decir que existen 3 tipos de nomenclatura: sistemática, stock y tradicional. Cada compuesto químico se puede nombrar de 3 maneras, pero esto es memorizar mucho para luego usar solo una. Así que solo aprenderemos la manera más común de nombrar a cada tipo de compuesto.
HIDRUROS METÁLICOS
Un hidruro metálico es:
METAL + HIDRÓGENO
La fórmula general es:
MHm
Siendo M el símbolo del metal, H hidrógeno y m la valencia del metal.
Realmente habría que poner M1Hm, siendo 1 la valencia del hidrógeno. Pero el 1 no se pone para simplificar. Las valencias se intercambian: el metal se queda con la del hidrógeno, y el hidrógeno con la del metal.
A la hora de leer una fórmula, se lee del final al principio, indicando los número con los prefijos
1 = MONO
2 = DI
3 = TRI
4 = TETRA
5 = PENTA
6 = HEXA
7 = HEPTA
Por ejemplo:
LiH = Hidruro de litio
BeH2 = Dihidruro de berilio
AlH3 = Trihidruro de aluminio
HIDRUROS NO METÁLICOS I
Existen dos tipos de hidruros no metálicos, por lo que vamos a diferenciarlos con I y II.
Los I son idénticos a los hidruros no metálicos:
NHn
N es el no metal (todos los no metales menos el C, F, Cl, Br, I, S, Se, Te)
H es el hidrógeno
n es la valencia del no metal
Por ejemplo:
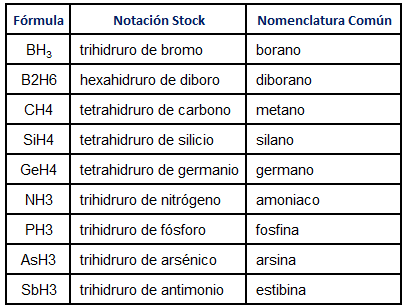
NH3 = Trihidruro de nitrógeno
PH3 = Trihidruro de fósforo
SiH4 = Tetrahidruro de silicio
GeH4 = Tetrahidruro de germanio
Con esta nomenclatura, todo el mundo científico se entiende, pero estos compuestos son muy antiguos, y esta nomenclatura es más o menos reciente, asi que muchas veces se usa el nombre que tenía antiguamente en vez de esta nomenclatura. Es importante saber usar esta nomenclatura, y los nombres comunes:
HIDRUROS NO METÁLICOS II
La diferencia es que si el no metal es F, Cl, Br, I, S, Se, Te; se coloca primero el hidrógeno y luego el no metal, es decir:
NHn → HnN
Siendo N el no metal, H el hidrógeno y n la valencia del no metal.
Por ejemplo:
HF = ÁCIDO fluorHÍDRICO
HCl = ÁCIDO clorHÍDRICO
HI = ÁCIDO yodHÍDRICO
H2S = ÁCIDO SULFHÍDRICO
ÓXIDOS
Un óxido es:
METAL / NO METAL + OXÍGENO
La fórmula general es:
X2Ox
X es el metal o el no metal, 2 es la valencia del oxígeno, O es el oxígeno, x es la valencia del metal o el no metal.
De nuevo, las valencia se intercambian: el oxígeno se queda con la valencia del metal - no metal, y el metal - no metal se queda con la valencia del oxígeno.
Por ejemplo:
Na2O = Monóxido de disodio
H2O = Monóxido de dihidrógeno (obviamente, esto no se usa, se usa agua)
Al2O3 = Trióxido de dialuminio
P2O5 = Pentaóxido de difósforo
Ca2O2 = CaO = Monóxido de calcio
S2O4 = SO2 = Dióxido de azufre
Se2O6 = SeO3 = Trióxido de selenio
En 2005, la IUPAC (de la que hablaremos al final de la unidad) decidió que los óxidos de halógenos (los halógenos son F, Cl, Br, I) pasaran de ser X2Ox a OxX2.
Por ejemplo, antes de 2005, tendríamos:
Cl2O7 = Heptaóxido de dicloro
Ahora tenemos:
O7Cl2 = DiclorURO de heptaOXÍGENO
El porqué, la electronegatividad, pero esto ya es Química Intermedia.
SALES BINARIAS
Una sal binaria es:
METAL / NO METAL + NO METAL
Su fórmula general es:
XnNx
X es el metal / no metal, n es la valencia del segundo no metal, N es el segundo no metal, x es el metal / no metal.
Por ejemplo:
NaCl: ClorURO de sodio
KI = YodURO de potasio
CaF2 = DifluorURO de calcio
BrCl = ClorURO de bromo
B2S3 = TriSULFURO de diboro
PERÓXIDOS
El más difícil de todos los compuestos binarios, ya que son muy parecidos a los óxidos.
Un peróxido tiene como fórmula general:
M2(O2)m
Donde M es un metal (o hidrógeno), y m su valencia.
Por ejemplo:
Peróxido de lito = Li2(O2)1 = Li2O2 (no se simplifica)
Peróxido de hidrógeno = H2(O2)1 = H2O2 (no se simplifica)
En este caso sí se simplifica. ¿Qué se simplifica? Los número que están en rojo:
Ba2(O2)2 = BaO2
En el ejemplo del peróxido de litio, no se simplifica, porque el 2 y el 1 no se pueden simplificar:
Li2(O2)1
Ya hemos visto los peróxidos. Ahora, ¿cómo distinguir óxidos de peróxidos?
[1] Na2O2, ¿es el óxido de sodio o el peróxido de sodio?
Lo primero es saber la valencia del metal, en este caso, 1. Nos faltaría saber la valencia del oxígeno:
Si es -2, óxido
Si es -1, peróxido
Para ello, tenemos que saber que la suma de las valencias de una molécula es 0 (una molécula es neutra por definición). La valencia del oxígeno será la incógnita:
Valencia Na · nº átomos Na + Valencia O · nº átomos O = 0
1 · 2 + x · 2 = 0
2 + 2x = 0
2x = -2
x = -1
Luego es el peróxido de sodio.
[2] SO2, ¿es óxido o peróxido de azufre?
En este caso es muy fácil. El oxígeno está unido al azufre, el azufre es un no metal. Y los peróxidos solo pueden ser:
Metal + Oxígeno
Hidrógeno + Oxígeno
Luego no puede ser un peróxido, luego es un óxido.
Li2O2 = Dióxido de dilitio ( = peróxido de litio)
Li2O = Óxido de dilitio ( = óxido de litio)
Obviamente, es lo mejor a la hora de hacer un examen en el que te juegas tanto, y cualquier químico te entenderá. Pero eso no significa no saber diferenciar óxido de peróxido.
 Por último, y a modo de cultura científica para cerrar la unidad y el curso, una nota histórica sobre la IUPAC.
Por último, y a modo de cultura científica para cerrar la unidad y el curso, una nota histórica sobre la IUPAC.La IUPAC (Unión Internacional de Química Pura y Aplicada) vendría a ser la FIFA de la Química. Si todas las federaciones de fútbol de todos los países están afiliadas a la FIFA, todos los químicos de todos los países están "afiliados" a la IUPAC.
Se fundó en 1919, tras la Primera Guerra Mundial. ¿Por qué?
Nos encontramos con que los franceses escribían ClNa, mientras que los ingleses NaCl; que un mismo elemento tenía varios nombres dependiendo del país y que la masa atómica de un mismo elemento era mayor en un país que en otro. Esto dificultaba mucho la colaboración de una universidad francesa colaborara con una americana, o una rusa o una alemana.
La IUPAC cambió todo esto. Como curiosidad, en un libro antiguo de Química de instituto que tengo de la Segunda República, aparecen casi todas las fórmulas al revés: NaCl, IK, F2Ca ...
El primer contacto que tiene un alumno con la IUPAC es la formulación. La formulación de TODOS los compuestos inorgánicos viene recogida en el llamado "Libro Rojo", que se actualiza, la última vez en 2005. La formulación de TODOS los compuestos orgánicos puedes verla en este enlace. Pero no solo eso. En las Tablas Periódicas modernas, el nombre de los elementos y la masa atómica son establecidos por la IUPAC.
ALGUNOS EJERCICIOS PARA PRACTICAR

No hay comentarios:
Publicar un comentario