Pto. ebullición: 78 º C
Pto. fusión: - 114 ºC
(a) Indica el estado de agregación a 67 ºC, 0 ºC, - 15 ºC, 80 ºC, -115 ºC.
(b) ¿Qué proceso se produce si me encuentro a - 113 ºC y bajo la temperatura un grado? ¿ Y si luego subo dos?
(c) ¿Qué proceso se produce si me encuentro a 77 ºC y subo la temperatura un grado? ¿Y si luego bajo dos?
(d) Tenemos etanol a -200 ºC (sólido), y se somete a una fuente de calor constante. Explica lo que ocurre a nivel macroscópico y a nivel microscópico. Nombra cada uno de los procesos que ocurra.
La destilación es un proceso de separación que se basa en la diferencia de puntos de ebullición. Si tenemos una mezcla de un líquido A (pto. ebullición 20 ºC) y un líquido B (pto. ebullición 60 ºC), ycaliento la mezcla a, por ejemplo, 50 ºC, A pasará a gas (pudiéndose recoger con un destilador) y B se quedará en estado líquido (ya que no se alcanza nunca los 60 ºC). Al final, obtenemos A y B separados. Para hacerlo se realiza un montaje como el que aparece en la imagen.
Tenemos una mezcla de ácido acético (componente del vinagre, pto. ebull. 118 ºC) y etanol (pto. ebull. 78 ºC). Hacemos el montaje de la imagen y calentamos a: 30 ºC, 100 ºC y 123 ºC. ¿Qué obtendremos en cada caso? ¿En cuál la destilación será existosa, se conseguirá separar ácido acético y etanol?
El agua de mar es una mezcla de agua (H2O, pto. ebull. 100 ºC) y sales (principalmente NaCl, pto. ebull. 1413 ºC). Al calentar agua de mar a 200 ºC durante unas horas, observamos que el agua ha desaparecido y queda una costra blanca al fondo del recipiente. Explica lo que ha ocurrido.
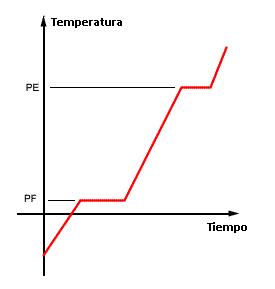 Se tiene un bloque de hielo que se caliente de manera constante. Cada minuto se toma la temperatura. Al hacer la gráfica nos encontramos con que al llegar a los puntos de fusión y ebullición, la temperatura se mantiene constante por unos minutos. ¿Por qué ocurre esto? (solución abajo)
Se tiene un bloque de hielo que se caliente de manera constante. Cada minuto se toma la temperatura. Al hacer la gráfica nos encontramos con que al llegar a los puntos de fusión y ebullición, la temperatura se mantiene constante por unos minutos. ¿Por qué ocurre esto? (solución abajo)Al tender una camiseta mojada, al cabo de un día, se seca. ¿Cómo ha desaparecido el agua si en ningún momento se ha llegado a alcanzar 100 ºC (como mucho, 40 ºC)? (solución abajo)
SOLUCIÓN EJERCICIO 3
Tenemos un hielo que calentamos. La energía calórica que le damos la invierte en hacer que las partículas (en este caso, moléculas de agua) vibren más rápido, aumenta la temperatura. Al llegar a 0º C, la energía no se invierte en hacer que vibren más rápido, si no en romper las fuerzas intermoleculares para pasar a agua líquida. Una vez rotas parte de esas fuerzas intermoleculares, la energía se vuelve a invertir en aumentar la temperatura, hasta llegar a 100 ºC, cuando se invierte en romper todas las fuerzas intermoleculares para pasar a gas. Por ello la temperatura se mantiene constante por un momento a 0º C (PF) y a 100 ºC (PE), ya que la energía se dedica a romper fuerzas intermoleculares, y no a hacer que las partículas vibren más rápido.
SOLUCIÓN EJERCICIO 4
Debemos distinguir entre ebullición (cuando pasa a gas en el punto de ebullición, por ejemplo, hervir agua) y evaporación (cuando pasa a gas antes del punto de ebullición, por ejemplo, este caso). Los dos procesos entran dentro de la vaporización (paso de líquido a gas, independientemente de la temperatura).
Esto ocurre porque, a 25 - 30 - 40 º C (la temperatura que suele hacer al Sol, sobretodo en verano), hay la energía suficiente como para que algunas moléculas de agua (de la fuerte vibración que experimentan) puedan "escapar" del líquido, y pasar a gas. La cantidad de moléculas con la energía suficiente como para "escapar" es muy baja, por lo que para que todas las moléculas escapen (la ropa se seque) debe pasar un tiempo grande (unas horas).

No hay comentarios:
Publicar un comentario